活检样本结合Phenoptics多色免疫荧光方案揭示黑色素瘤免疫微环境
联合抑制BRAF/MEK是治疗黑色素瘤的公认疗法。2020年7月30日,FDA批准了Atezolizumab联合Cobimetinib和Vemurafenib,用于BRAF V600突变阳性、不能切除或转移性黑色素瘤患者治疗。而BRAF/MEK抑制剂对抗肿瘤免疫反应的影响也逐渐受到关注。
对此,来自德国的Jürgen C. Becker教授研究团队分析了黑色素瘤患者在使用BRAF/MEK抑制剂治疗前和治疗期间的肿瘤活检样本,对患者在治疗过程中的免疫反应变化和机制进行了研究。

Becker教授的团队使用多重免疫荧光染色对肿瘤组织微环境进了分析,发现治疗后CD4+和CD8+ T细胞浸润增加。进一步分析T细胞受体来源,发现治疗诱导了T细胞克隆型丰富度和多样性的增加。这种扩增可能是通过诱导T细胞中的T-bet和TCF7来促进的。而这两种转录因子是CD8+记忆T细胞自我更新和持续存在所必需的。这些结果表明,对黑色素瘤患者的BRAF/MEK抑制可以通过诱导T-bet和TCF7,扩增已经存在的黑色素瘤特异性T细胞。
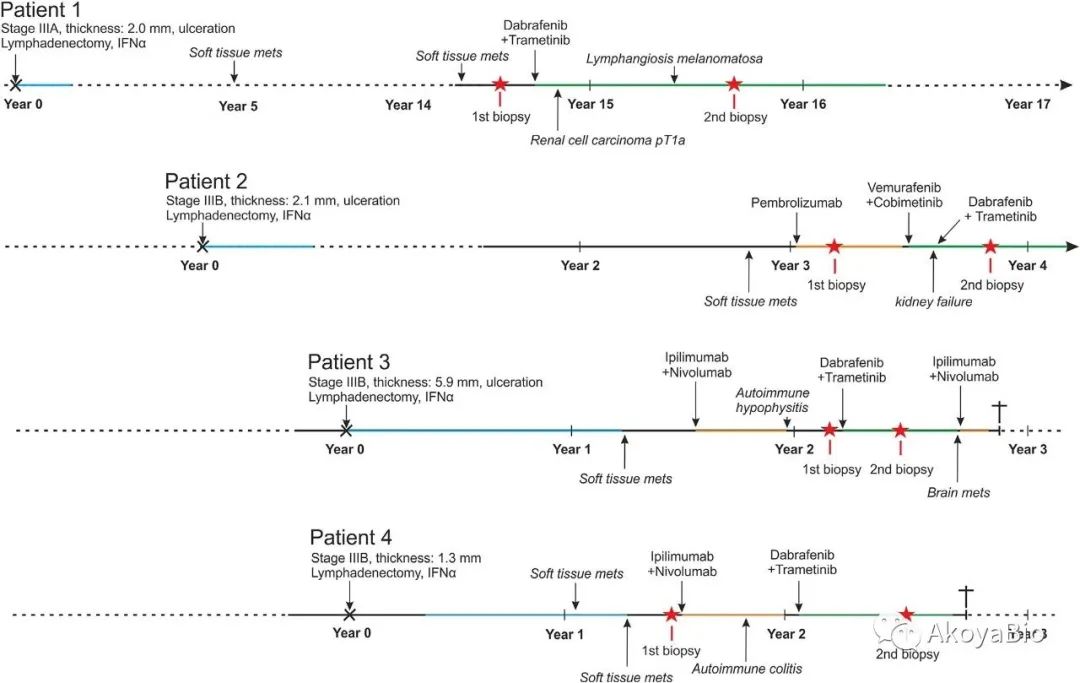
患者用药及活检样本采集历史信息
作者使用多色免疫荧光技术,对CD4(绿色)、CD8(黄色)、CD20(红色)、Foxp3(橙色)、CD68(紫色)、黑色素瘤标志物(MART-1,淡蓝色)、DAPI(蓝色)进行染色,观察BRAF/MEK靶向治疗引起的转移性病变中免疫浸润成分的变化。所有患者中CD4+ T细胞浸润增加,有2例患者中CD8+ T细胞浸润增加。
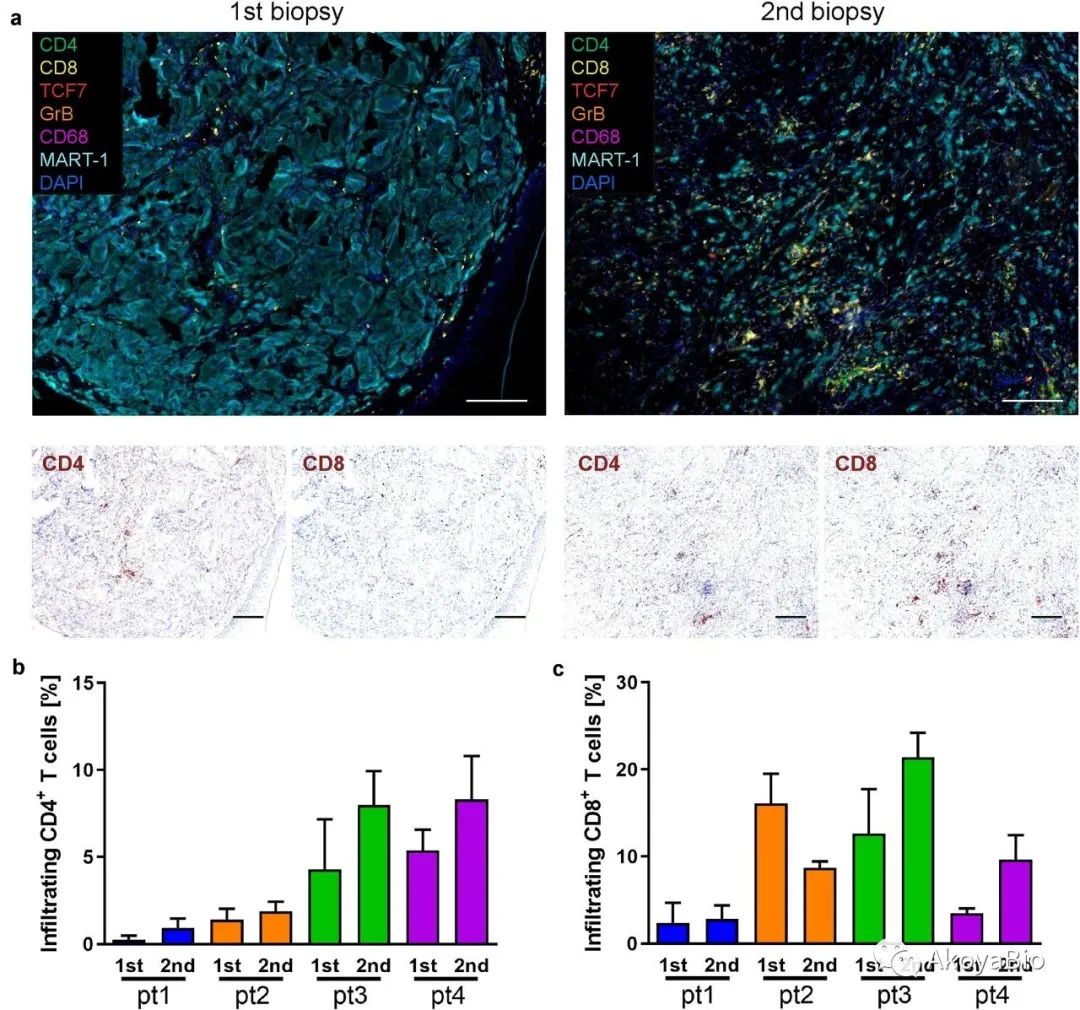
BRAF/MEK抑制增加T细胞浸润
作者进一步检测了转录因子TCF7和T-bet的mRNA水平,并通过多色免疫荧光验证CD8(黄色)、TCF7(红色)、GrB(橙色)、MART-1(浅蓝色)和TCF7的蛋白表达。观察到TCF7+细胞总数在治疗后增加,呈密集簇状存在,而不是分布在整个组织中。
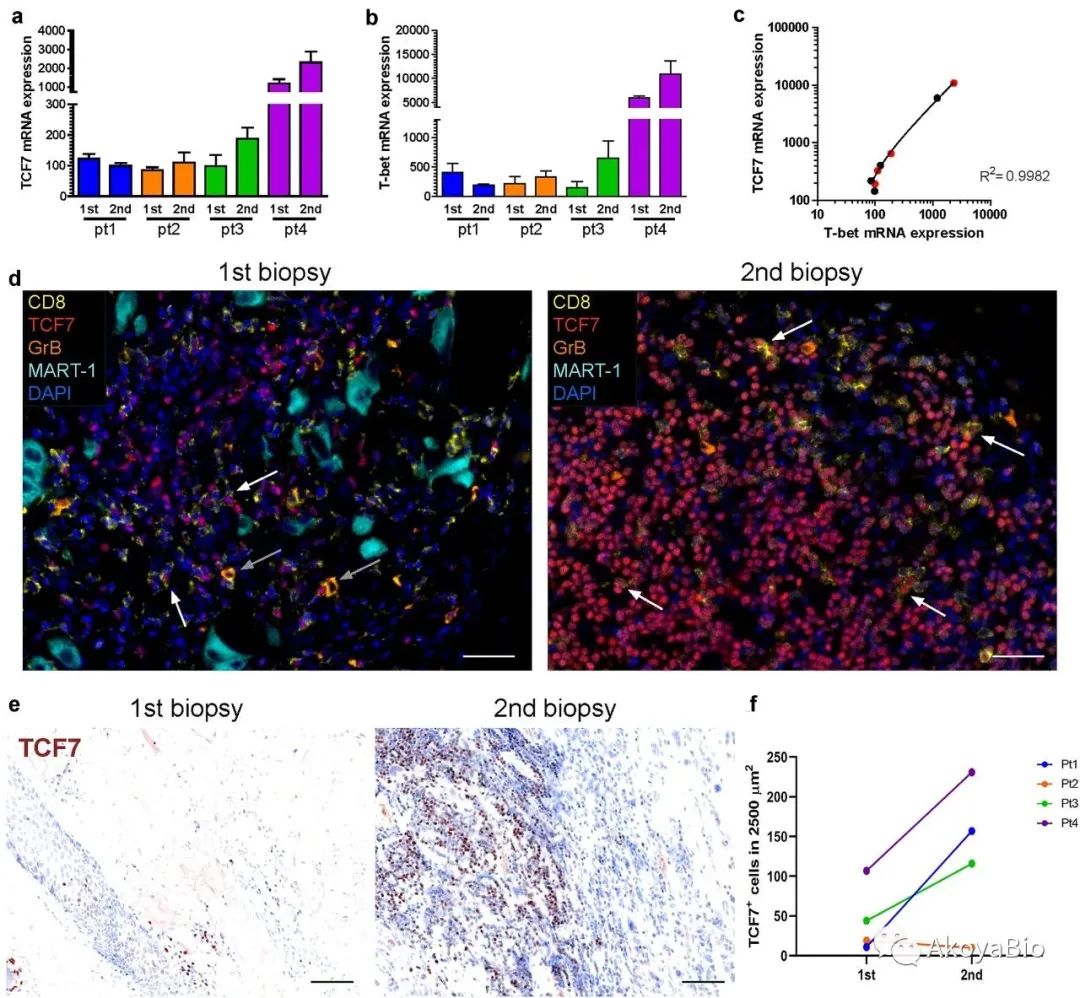
BRAF/MEK抑制后T-bet和TCF7表达上调