利用10x Genomics技术构建新冠肺炎单细胞免疫图谱并揭示重症致病机制
文章题目:Discriminating mild from critical COVID-19 by innate and adaptive immune single-cell profiling of bronchoalveolar lavages
发表期刊:Cell Research
影响因子:20.507
发表时间:2021年1月

研究背景
为了阐明先天性和适应性宿主免疫系统是如何恶化COVID-19免疫病理。本文使用10x Genomics单细胞RNA测序(scRNA-seq)结合T细胞受体测序(TCR-seq)和B细胞受体测序(BCR-seq)共同绘制了COVID-19肺炎的深度免疫图谱,分析了31例轻症或危重症COVID-19患者的支气管肺泡灌洗液(BAL)样本,同时与非COVID-19肺炎和正常肺的BAL进行了比较。构建了T细胞、单核细胞到巨噬细胞的轨迹,该研究为区分非特异性肺局部炎症信号和COVID-19特异性肺部相关免疫变化提供了可靠的依据。
研究结果
该研究对22位新冠肺炎和13位普通肺炎病人的肺泡灌洗液进行了10x Genomics单细胞转录组、免疫组 (TCR, BCR) 联合测序,系统构建了新冠肺炎免疫反应图谱 (图1),第一次在单细胞水平上比较了新冠肺炎与普通肺炎在致病机制上的区别,并在整合公共数据分析后揭示了轻症转为重症新冠肺炎的关键免疫学动态机制。
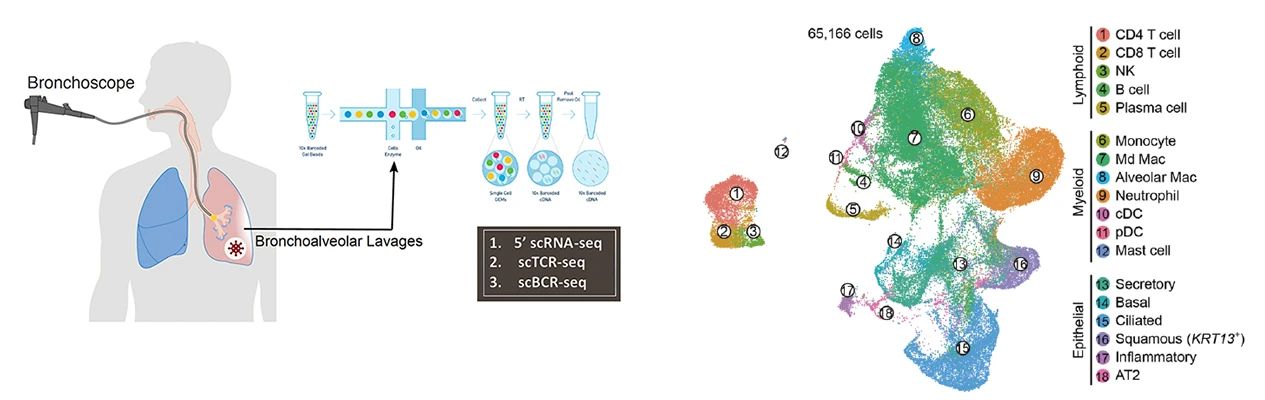 图1-新冠肺炎肺泡灌洗液单细胞转录组、免疫组测序
图1-新冠肺炎肺泡灌洗液单细胞转录组、免疫组测序
该研究发现新冠患者的肺泡灌洗液微环境出现了显著的细胞组份变化,包括出现了大量活化的中性粒细胞、单核细胞、B细胞、NK细胞等,但肺泡巨噬细胞、上皮细胞等类型却明显减少。对每种细胞类型进行深度聚类分析后,该研究定义了由多达50种细胞表型组成的肺炎肺泡灌洗液单细胞图谱。后续的轨迹分析发现多种免疫细胞类型的分化存在显著差异 (图2)。比如中、轻症新冠患者较重症具更多CD8+ TRM细胞和CD4+ TH17细胞的分化,其中前者出现明显TCR克隆增值;而在重症病人中则涌现大量促进炎症反应的CD8+ TEX和CD4+ TH1 细胞分化,后者出现大幅度TCR克隆增值。此外,新冠患者浆细胞BCR克隆增值明显,但很快进入功能障碍的终末期。该研究还发现重症患者单核细胞出现强烈炎症表型,其向巨噬细胞分化的能力却被削弱,以至缺乏肺泡巨噬细胞来清理被病毒感染的细胞。
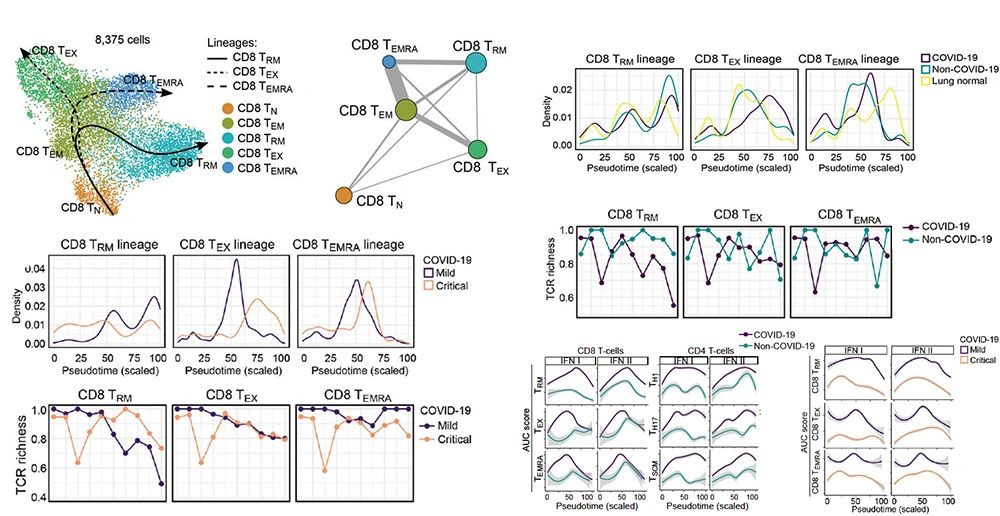
图2-CD8+T细胞分化轨迹以及其在新冠肺炎中的病理改变
该研究进一步从单细胞转录组数据中分析出病毒特异性基因的表达 (图3),并发现新冠病毒基因不仅在被感染的上皮细胞中表达,也在多种免疫细胞中表达。更有意思的是,新冠病毒的11种主要基因呈现出差异性表达,比如S基因主要在上皮细胞中表达,而N和ORF10等在免疫细胞中的丰度更高。进一步分析发现表达S基因的上皮细胞出现了增强病毒复制与增殖的免疫逃逸现象,而表达N基因的中性粒细胞则出现了显著的先天性免疫激活,提示中性粒细胞在主动清理病毒过程中发挥重要作用。但此类中性粒细胞同时表达大量炎症细胞因子并表现出长时间不受控制的激活状态,这可能是导致细胞因子风暴和重症进展的主要元凶。
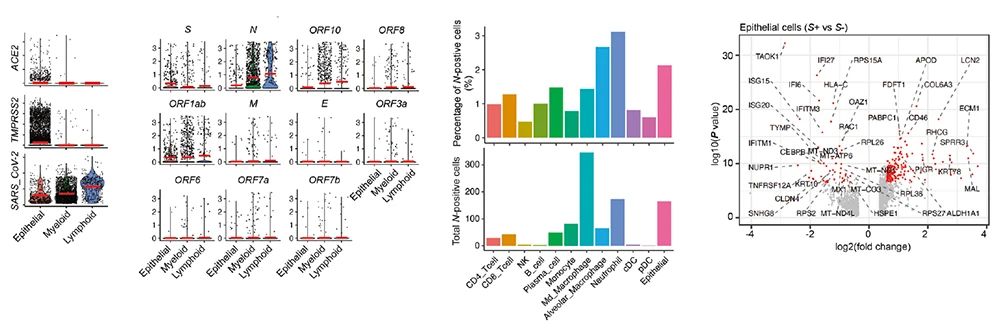
图3-新冠病毒基因在不同细胞类型中的差异性表达
最后,该研究分析了以多种病理细胞表型作为治疗靶点的可行性,并讨论了目前用地塞米松等激素疗法治疗重症新冠肺炎的潜在作用机制,为研发新的抗击新冠病毒和挽救重症患者的方法提供了重要的理论支持。
研究结论
利用10x Genomics单细胞转录组学研究SARS-CoV-2的先天性和适应性肺部免疫应答。观察到SARS-CoV-2感染过程中免疫细胞组成、表型和免疫交叉的显著变化,并确定了COVID-19轻度和重度的几个明显的免疫特征。同时记录了几条免疫通路的基因足迹,它们与COVID-19病理和SARS-CoV-2感染生物学有关。该研究对了解COVID-19肺炎患者肺局部免疫具有重要意义,对COVID-19免疫研究、COVID-19患者免疫监测及相关治疗发展提供新的见解。