利用10x Genomics技术绘制乳腺癌抗PD1治疗过程中肿瘤细胞变化的图谱
文章题目:A single-cell map of intratumoral changes during anti-PD1 treatment of patients with breast cancer
发表期刊:Nature Medicine
影响因子:36.13
发表时间:2021年5月

研究背景
三阴性乳腺癌(TNBC)占所有乳腺癌(BC)患者的15%,是一种与预后不良相关的异质性肿瘤。在所有BC亚型中,TNBC显示出最高数量的肿瘤浸润淋巴细胞(TILs),这表明TNBC可以受益于免疫检查点封锁(ICB)。近期的乳腺癌临床试验数据表明,ICB联合新辅助化疗可提高患者完全缓解率和无事件生存率,然而,并非所有的BC患者对新辅助ICB都有反应。为了确定BC特异性ICB应答的机制,作者通过对BC治疗前后匹配的活检组织进行单细胞测序,来监测肿瘤内的变化。
研究设计
该研究对29名初诊病人和11名经过新辅助化疗乳腺癌病人进行肿块细针活检后给予10天左右抗PD1抗体治疗,然后再手术切除肿块,并对免疫治疗前后的活检和术后肿块组织进行单细胞转录组联合免疫组库测序(scRNA-seq +scTCR-seq)以及单细胞转录组联合蛋白组测序(CITE-seq),并分析了免疫治疗前后肿瘤微环境内细胞组分的变化,从而鉴定出对免疫治疗结局有潜在贡献的特定细胞类型,特别是与T细胞克隆增殖相关联的细胞亚型。

研究结果
1. 表达PD1的T细胞在抗PD1处理后明显增殖
对29例初诊患者,抗PD1治疗前后进行scRNA-seq,共获得175,942个高质量细胞,聚类后获得恶性乳腺上皮细胞、免疫细胞、内皮细胞和成纤维细胞几种主要细胞群。使用scTCR-seq来定义51,499个T细胞中基于共享TCR序列的克隆型,在设定的共享序列细胞数大于2和大于5的两个阈值中,发现9个患者在治疗前后有明显的克隆扩增。将有克隆扩增和无克隆扩增的患者分别定义为Es和NEs,比较发现,NEs中成纤维细胞较多,Es中T细胞较多,但肿瘤突变负荷和染色体不稳定性没有差异。对T细胞单独聚类,发现CD8+及CD4+集群表达PD1,TEX亚群在Es中克隆扩增能力显著增强,而且处理前后,Es的克隆型丰富度低于NEs。整体结果表明,T细胞的克隆扩增能力,是与PD1+的T细胞相关的,CD8+和CD4+TEX细胞是抗PD1后扩增的大多数T细胞。

图1 乳腺癌PD1治疗前后细胞图谱变化
2. T细胞沿着CD8+TEX细胞克隆增殖
对T细胞进行发育轨迹分析,发现存在3个不同的分化方向,TEX2细胞、驻留记忆CD8+T细胞(TRM)和激活效应/记忆T细胞(TEMRA细胞)TCR丰富度沿轨迹下降,且TEX细胞主要处于分化轨迹的末端。在所有轨迹中,Es的TCR丰富度低于NEs,与前处理相比,处理后的下降更明显,反映了抗PD1诱导的T细胞持续扩增。

图2 CD8+T细胞扩增轨迹分析
3. T细胞克隆扩增过程中基因表达变化
发现了五组沿着CD8+TEX轨迹的差异表达基因(DEGs),且在每个基因集合中鉴定了几个以前未被识别的T细胞标记基因。虽然轨迹分配的细胞在相同的拟时间具有相似的表达,我们观察到一些基因在E和NE轨迹之间有差异表达,通路分析显示Es中干扰素(IFN)反应上调,氧化磷酸化下调。与CD8+T细胞相似,CD4+TNEs中RUNX3和CBFB减少,而Es中IFN-α/γ反应增加。因此,沿着轨迹的基因表达谱可以识别Es和NEs之间差异表达或激活的标记或通路。
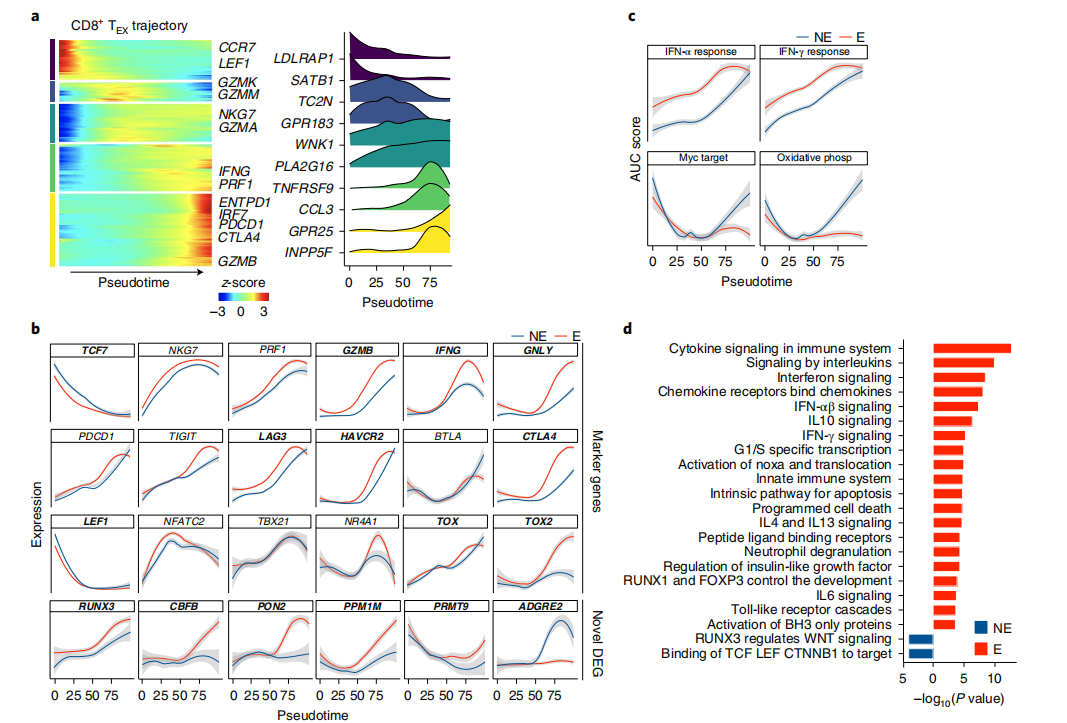

图3 CD8+TEX轨迹的差异表达基因
4. T细胞的表达特征预测T细胞的扩增
接下来,作者鉴定了扩增的T细胞与未扩增的T细胞之间的差异基因,未扩增的T细胞更幼稚,而扩增的T细胞表现出高效应功能,并使用基因集富集分析确认了相关功能。免疫检查点标记物和CD4+TH1活性在Es和NEs预处理中最能预测T细胞扩增,CITE-seq证实NEs中幼稚T细胞标记物高于Es,而免疫检查点、肿瘤反应和共刺激标记物减少。当Es、TNBC(n=5)与ER+BC(n=3)比较时,扩增的克隆型数量没有差异。然而,预处理后的T细胞中PD1的表达和增殖T细胞的数量在TNBC中更高。在TNBC中,Es也表现出CD8+T细胞效应功能基因表达增加、CD4+TH1活性和免疫检查点基因预处理增加。
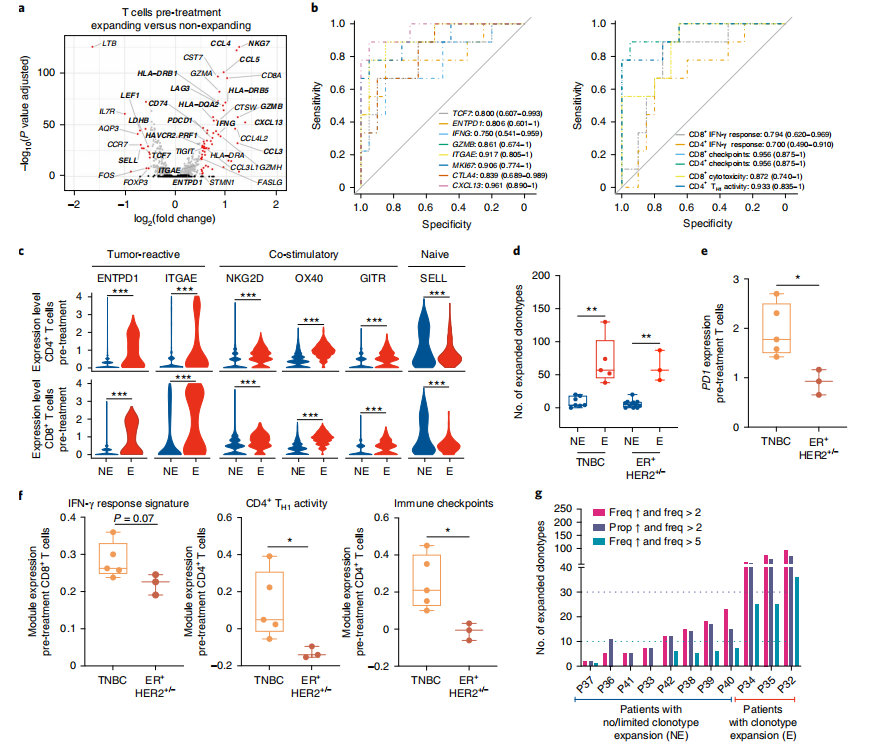
图4 在BC和BC亚型中,增殖T细胞和非增殖T细胞特征
5. 树突状细胞与T细胞扩增关系
树突状细胞(dc)在调节CD8+T细胞免疫和肿瘤抗原耐受之间的平衡中起着核心作用。对来自仅接受抗PD1(n=29)治疗的患者的2410个DC进行了亚聚,发现6种表型,与NEs相比,Es致DC中PD-L1 (CD274)和PD-L2 (PDCD1LG2)升高。免疫组化证实,治疗前和治疗后Es的PD-L1均较高。在DC亚型中,PD-L1仅由mregDC表达。Es和NEs的相对DC频率前处理没有差异,除了mregDC在Es前处理中富集。在Es治疗组中,pDCs, ASDCs 和 mregDCs富集频率明显升高,CXCL9和CXCL10是T细胞向肿瘤迁移的重要因素,在Es中与IFN反应和抗原呈递相关的基因升高。

图5 表达PD-L1的树突状细胞与T细胞的扩增相关
6. T细胞克隆扩增的肿瘤更容易受PD1治疗的影响
因为T细胞的活性依赖于癌细胞的肿瘤抗原呈递,作者也研究了癌细胞。与治疗前相比,治疗后Es细胞数量减少。虽然在癌细胞中检测到PD-L1,但许多抗原呈递主要组织相容性复合体(MHC) I/II类基因在NEs中下调。比较Es治疗前和治疗后,证实了正在进行的抗肿瘤免疫反应,细胞增殖、蛋白水解、细胞死亡、免疫信号通路和细胞毒性通路富集于Es治疗后的癌细胞中。最后,作者探讨了哪些细胞类型和表型预处理与T细胞扩增相关,通过不同细胞群之间的互作关系,描述了治疗前活检中与抗PD1治疗后T细胞扩增相关的互动免疫环境。

图6 交互免疫环境与T细胞扩增正相关
结 论
文章通过对比治疗前后出现T细胞克隆增殖与未出现克隆增殖病人的免疫微环境改变,揭示了多种免疫细胞在免疫治疗中的分化规律, 以及可能的作用机制。并进一步发现乳腺癌中表达PD-L1的主要细胞类型并不是肿瘤细胞而是巨噬细胞和树突状细胞,而后两者的PD-L1高表达可预测免疫治疗反应。最后,该研究通过生信分析挖掘了能够预测免疫治疗反应的生物标记物,并有望在筛选潜在获益人群的临床治疗分层实践中得到应用。
【参考文献】
A single-cell map of intratumoral changes during anti-PD1 treatment of patients with breast cancer. Nature medicine. 2021 May