Phenoptics多色免疫荧光方案 – 如何建立稳定可靠的染色、拍摄及分析整体方案
Phenoptics方案中使用 Opal 荧光染料, Vectra Polaris多光谱扫描成像, inForm 软件分离每个荧光染料的准确光谱特征,以正确分离每标志物染色的复合图像,以及分离和去除组织自发荧光。
随着免疫肿瘤学 (I/O) 成为对抗癌症的有效方法,多色免疫荧光(mIF)的多光谱成像系统正在逐渐发展成一种可靠的分析平台。Phenoptics多色免疫荧光(mIF)可以同时检测多个生物标志物,对肿瘤微环境中复杂的生物学进行更深入的探索,检测与临床结果相关的细胞间空间相互作用,同时生成适用于高样本通量的可靠且可重复的结果。一项跨学科研究收集了10多种癌症类型和8000多名患者样本,证明了多色免疫荧光可可靠地用于确定抗 PD-1/PD-L1治疗的反应可能性[1] 。
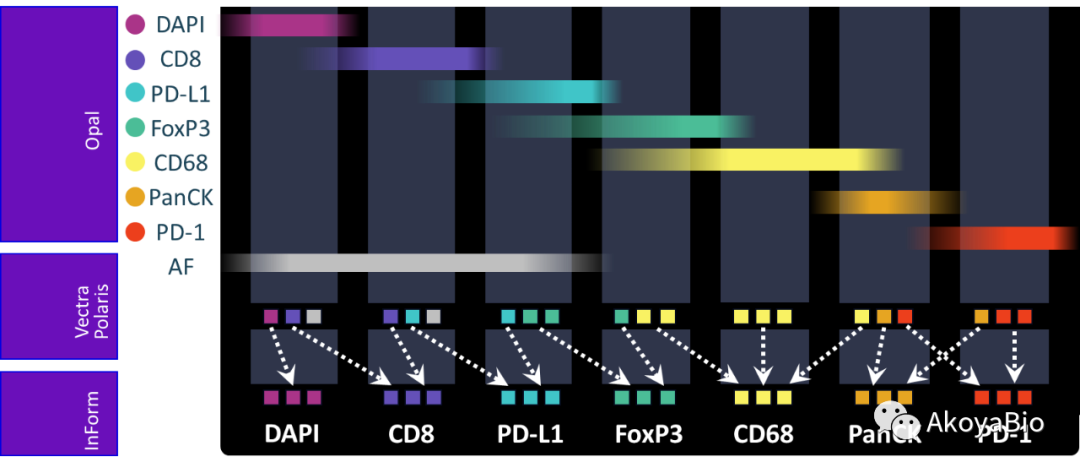
Phenoptics方案中使用 Opal 荧光染料, Vectra Polaris多光谱扫描成像, inForm 软件分离每个荧光染料的准确光谱特征,以正确分离每个标志物染色的复合图像,以及分离和去除组织自发荧光。
建立稳定可靠的多色免疫荧光实验体系的原则
多色免疫荧光(mIF)图像中的每个像素都应保存精确数据,以反映目标蛋白质的相对丰度。参考ELISA 蛋白质测量的分析标准,检测一种或多种标记的真正阳性细胞结果偏差 (CV) 大约为 10% [2]。达到这一级别的稳定性,才有可能支持发现真实且可重复的生物标志物、达到研究和临床试验的质量、监管和分析要求。
匹配现有IHC结果
mIF 与高度优化的常规显色 IHC 染色法的灵敏度相匹配 [3,4] 。IHC 是目前广泛认可并用于临床的检测方法。常规IHC结果判读依赖病理医生,其阳性检测是利用视觉灵敏度来检测背景染色之上的特定染色。然而,视觉评估受到多指标同时染色的检测水平和人类感知主观性的限制 [5,6,7] 。当迁移到多色免疫荧光定量分析时,软件定量分析需支持每个标记的独立染色呈现、线性动态范围对标志物表达水平的定量测量、准确和可重复的分析其在 TME 结构内和整个切片内的细胞共同表达、排列和定位,和现有IHC结果一致。
建立一致、准确的图像分析以及实用和快速的工作流程
多色免疫荧光染色结果的分析依赖染色方案的设计和图像的分析算法。这需要染色荧光信号强而稳定,支持快速载玻片扫描和在几个月后的重新扫描。荧光稳定性包括避免强激发光漂白的光稳定性和储存载玻片的稳定性。
不同操作人员和实验室之间的可重复性
检测工作流程需要实用、经济并符合研究和研究实验室标准,以便所有研究人员都可以使用该方法,从而加速并增加找到最有效生物标志物的可能性。拥有符合临床实验室标准和工作流程的工作流程支持病理学家继续发挥关键质量控制和数据审查作用,充分利用现有检测实验室和临床人员,以及临床医生快速获得可靠信息的需求。
如何建立稳定可靠的Phenoptics多色免疫荧光方案
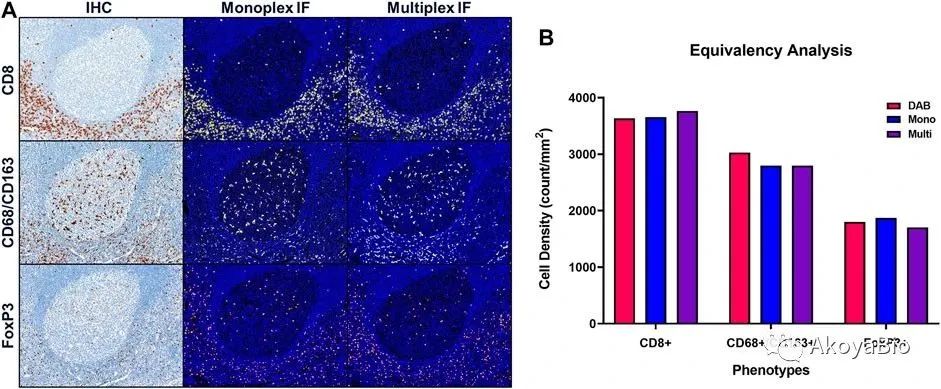
每个蛋白指标的染色都需要使用IHC染色结果验证。通过每个蛋白指标荧光染色的位置和强度与IHC结果的对比,确认单个标志物荧光染色的准确性和特异性。我们建议进行严格的图像分析,对阳性细胞进行计数,并确认荧光染色显示的细胞数量与 IHC 显示的数量相同,偏差范围控制在 10%–20%之内。
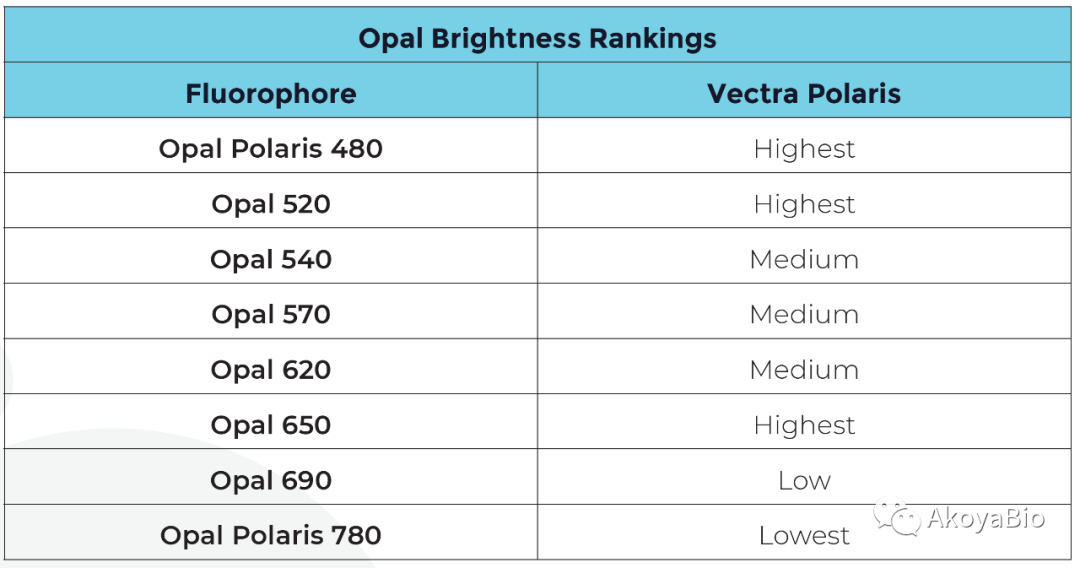
根据每个蛋白指标的表达特点和Opal染色荧光强度设计多色免疫荧光染色方案。一般低表达标志物匹配更亮的荧光染料,而高表达标志物匹配相对较暗的荧光染料。
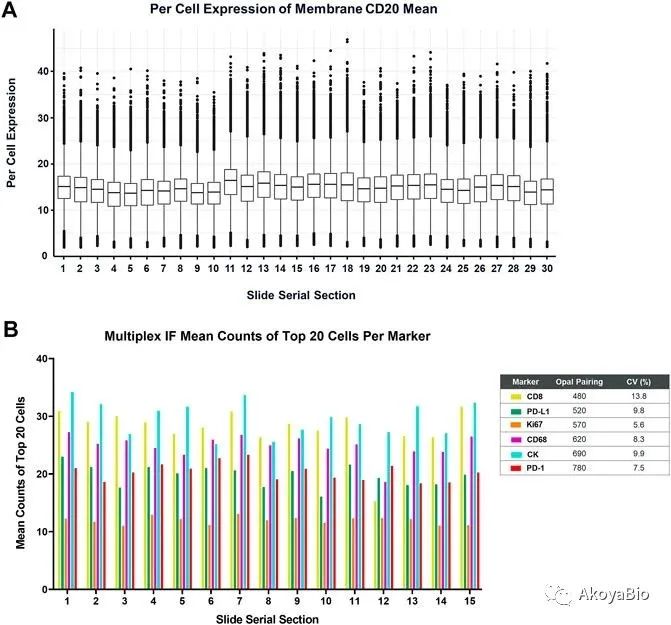
使用自动化染色,需对设备进行日常维护和定期性能测试对于获得一致和可靠的数据至关重要。如下图,对30张连续切片进行染色后,对其定量结果进行比较。
稳定染色方案的特点
优化良好的检测的关键性能参数是信号强度、信号平衡、标记独立性、染色均匀性、随时间推移的可重复性,最重要的是从转化的角度,在不同实验室直接可获得相同的结果。
信号强度
根据 inForm软件的计算,Opal染色的目标范围在 10~30定量范围内,其中 Opal Polaris 780推荐的范围是 1~10 。上述范围支持可靠和准确的数据分析。值得注意的是,当信号过低或高达 50 以上时仍然可以获得可行的数据,但存在荧光信号之间串色风险。
动态检测范围
我们评估动态范围的标准方法是通过将前 20 个最亮细胞的平均值除以最弱 10% 细胞的平均强度来计算信噪比 (SNR)。10 或更高的 SNR 支持可靠的图像分析,包括准确计数阳性细胞和量化表达水平。虽然我们建议 SNR 为 10 或更高,但对于高性能抗体,典型比率在 100 左右,或者低至 3 比 1 仍提供分析价值。
荧光信号的平衡
对于经典的 Opal 系列(Opals 520、540、570、620、650 和 690),经验法则是将相邻通道之间的信号比设为 3:1 或更小。大多数情况下,当比率超过 3 时,分析表现非常好,串色可忽略不计。随着 MOTiF的推出,将 Opal 540 替换为 Opal Polaris 480,将 Opal 650 替换为 Opal Polaris 780。除 Opal Polaris 780 外,所有Opal染料强度在 10~30 范围内,是实现最佳信号平衡和 10 或更高 SNR 的关键。信号平衡的目标是实现可忽略的串色。
荧光串色
串色应该最小化或消除。因为串色会影响相邻信号通道时,导致定量不准确或缩小重要表达标志物的动态可检测范围。对于稳定的检测,建议残留串色小于 1%,以确保对图像分析的干扰最小。通常情况下,没有可测量的串色。
可重复性
大约 10% CV 或更好的再现性是优化良好的多色免疫染色方案的典型特征,为了评估多光谱 mIF 的分析性能及其支持未来临床应用的适用性,进行了 MITRE 研究[8]。扁桃体样本的连续切片、试剂盒分发到六个临床研究中心的实验室。每个实验室使用标准染色和拍摄方案,使用针对 PD-1、PD-L1、CD8、CD68、Foxp3 和 CK 的优化检测面板对载玻片进行染色。对信号强度的站点内和站点间一致性分析进行了评估。
荧光稳定性
为了确保分析的稳健性并支持最终的临床应用,荧光信号不仅需要光稳定,以允许重复扫描,而且在长时间保存过程中需要同样稳定,以便存储数月而不会出现明显的信号损失。使用 Opal TSA 检测的多重检测可以在 6 个月内重复扫描,同时在室温下储存,信号损失 <10%。
综上,Phenoptics多色免疫荧光整体方案,在标记丰富的标志物同时,提供快速、全载玻片分析自动化和独立于操作员的试验操作和结果判读,建立一套实用、经济和分析上可靠的工作流程。
【参考文献】
1. Lu, S., et al. (2019). Comparison of Biomarker Modalities for Predicting Response to PD-1/pd-L1 Checkpoint Blockade. JAMA Oncol. 5, 1195.
2. Gupta, et al. (2017). 2017 White Paper on Recent Issues in Bioanalysis: a Global Perspective on Immunogenicity Guidelines & Biomarker Assay Performance (Part 3 - LBA: Immunogenicity, Biomarkers and PK Assays). Bioanalysis 9 (24), 1967–1996.
3. Kim, et al. (2016). Immunohistochemistry for Pathologists: Protocols, Pitfalls, and Tips. J. Pathol. Transl Med. 50 (6), 411–418.
4. Parra, et al. (2017). Validation of Multiplex Immunofluorescence Panels Using Multispectral Microscopy for Immune-Profiling of Formalin-Fixed and Paraffin-Embedded Human Tumor Tissues. Sci. Rep. 7 (1), 13380.
5. Sapino, et al. (2013). Current Challenges for HER2 Testing in Diagnostic Pathology: State of the Art and Controversial Issues. Front. Oncol. 3, 129.
6. Troncone, G., and Gridelli, C. (2017). The Reproducibility of PD-L1 Scoring in Lung Cancer: Can the Pathologists Do Better. Transl. Lung Cancer Res.
7. Santana (2018). Errors in Surgical Pathology Laboratory. IntechOpen: Quality Control in Laboratory.
8. Hoyt, et al. (2019). Multi-institutional TSA-Amplified Multiplexed Immunofluorescence Reproducibility Evaluation (MITRE Study): Reproducibility Assessment of an Automated Multiplexed Immunofluorescence Slide Staining, Imaging, and Analysis Workflow. Atlanta, GA: American Association of Cancer Research.